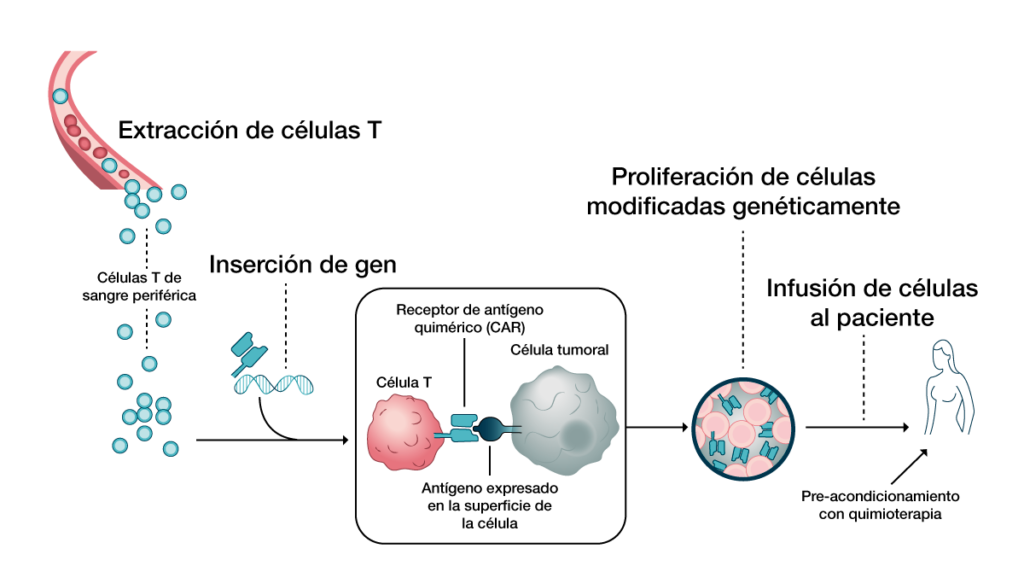
Las células T receptoras de antígenos quiméricos (CAR-T) son células rediseñadas que expresan una proteína de fusión dirigida a un antígeno tumoral, estas al asociarse con un antígeno objetivo, se activan y se liberan diversas citocinas, desgranulación citolítica, destrucción de células tumorales y proliferación de células.
Las células CAR-T incluyen tres partes (dominios):
- De reconocimiento de antígeno extracelular de la variante de fragmento de cadena única (scFv).
- Transmembrana.
- De activación de células T intracelulares (Figura 1).
Este tipo de células están diseñadas para redirigir a las células T de un paciente o donante y destruir las células tumorales de manera específica, logrando un avance significativo en el campo de la inmunoterapia contra el cáncer.
También tienen un enfoque importante en neoplasias malignas, hematológicas y tumores sólidos que no tengan restricción del complejo mayor de histocompatibilidad.
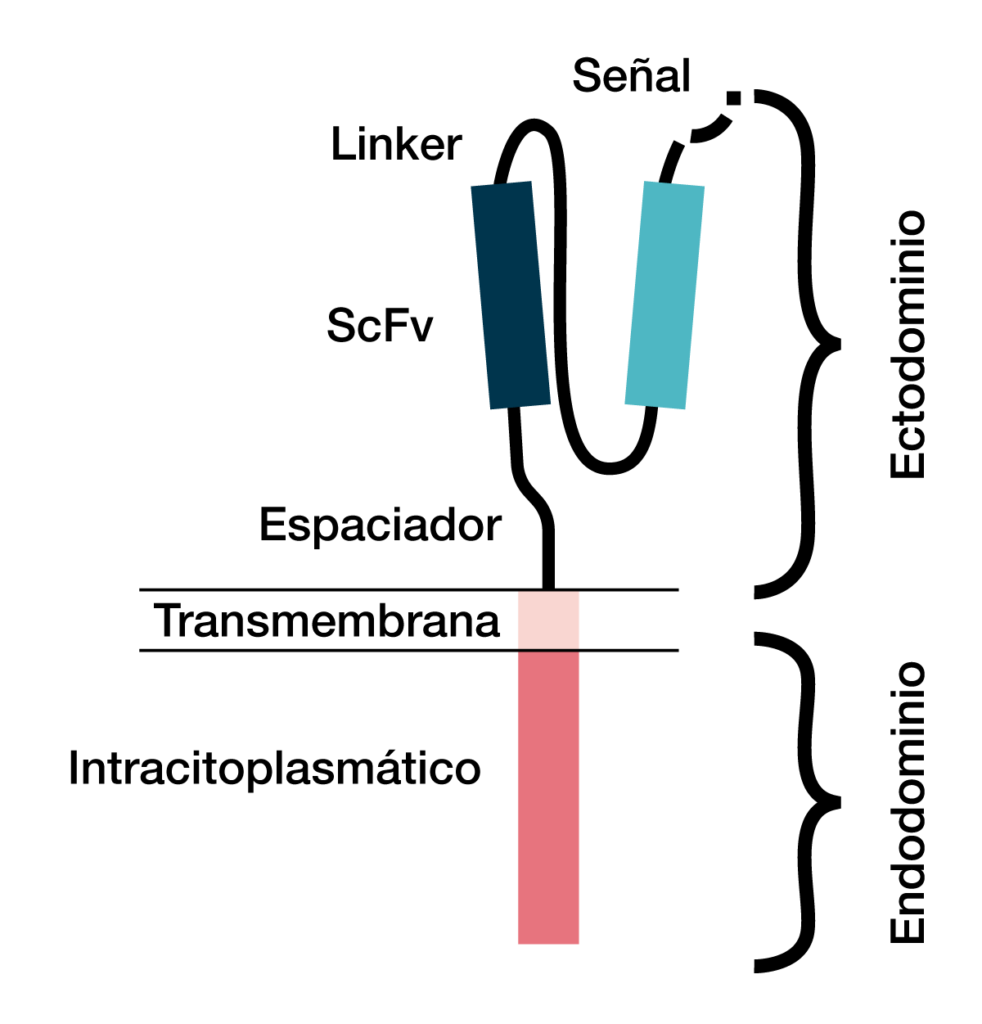
Figura 1. Estructura del receptor de antígeno quimérico (CAR) con sus tres dominios (ectodominio, dominio transmembrana y endodominio)
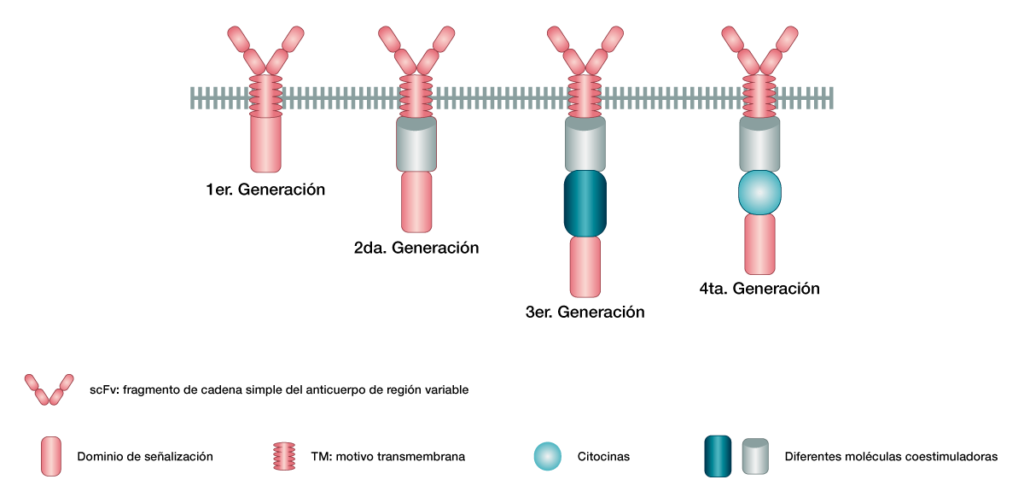
Tipos de generación en las células CAR
- Primera generación: son proteínas con un dominio de unión extracelular unido a un dominio de señalización que se encuentra intracelular. Estas pueden reconocer antígenos tumorales y elevar la actividad antitumoral de las células T, pero el efecto terapéutico no es satisfactorio in vivo, ya que su capacidad de proliferación es reducida.
- Segunda generación: son las que cuentan con un dominio coestimulador CD28 0 4-1BB con la molécula CD3ÿ, ayudan a la expansión y permanencia de las células modificadas genéticamente in vivo.
- Tercera generación: estas cuentan con varios dominios coestimuladores que translucen las señales domino basadas en las células de segunda generación.
- Cuarta generación: están redirigidas a destruir de manera universal a las citoquinas mejorando la citotoxicidad tumoral al superar la red del microambiente tumoral, como se pueden ver en la figura 2.
Actualmente, existen tres productos aprobados por la FDA para uso clínico. Uno es utilizado para leucemia linfoblástica aguda (LLA) pediátrica y los subtipos de linfoma de células B grandes difusas en adultos. Otro producto es para subtipos de linfoma de células B grandes difusas (DLBCL) y el más reciente aprobado es usado para linfoma de células del manto (MCL).
El desarrollo por esta nueva clase de tratamiento ha tenido algunos obstáculos, ya que se han presentado reacciones adversas graves como liberación de citocinas, neurotoxicidad, síndrome de lisis tumoral, toxicidad del objetivo fuera del tumor, así como un costo poco accesible.
Las células CAR-T y su importancia en la destrucción de células tumorales
Las células CAR-T no se restringen por el complejo mayor de histocompatibilidad (MHC) al ser reconocidos por los antígenos asociados a tumores (TAA). Tienen especificidad de unión al antígeno CAR.
Además, al ser introducidas al cuerpo atacan a las células positivas para CD19. Una vez que se unen a los TAA específicos, inician su activación a través de la fosforilación y proliferación en grandes cantidades. La respuesta anticancerígena dada es por la citotoxicidad y secreción de citocinas.
Las células CAR-T CD8 tienen un papel importante en la destrucción de células tumorales y las CAR-T CD4 positivas tienen un papel de asistencia que puede ayudar a fortalecer la respuesta inmune antitumoral.
Las células CAR-T secretan granzima y perforina que pueden causar daño a las células tumorales y también liberar diferentes citocinas, además pueden mejorar la eliminación del tumor al activar las células inmunitarias.
Otra forma de citotoxicidad es mediante la estimulación por apoptosis inducida para activar las vías de señalización apoptótica dentro de las células cancerosas, como se puede ver en la figura 3.
Actualmente, la inmunoterapia ha tenido grandes avances en efectos clínicos con resultados positivos entre los diversos tipos de terapias como:
- Terapia génica.
- Tratamiento con anticuerpos.
- Terapia celular.
Las células CAR-T aún se encuentran en etapas de desarrollo, enfrentando diversos problemas en el ámbito científico, antes de aplicarse de manera general. Actualmente, se están desarrollando diversos estudios para reducir los niveles de toxicidad y neurotoxicidad, dando lugar a nuevos protocolos y así garantizar la seguridad de estas, para establecer nuevas estrategias y soluciones posibles para tener futuras terapias más efectivas.
Bibliografía
Tudor, T., Binder, Z. A., & O’Rourke, D. M. (2021). CAR T Cells. In Neurosurgery Clinics of North America (Vol. 32, Issue 2, pp. 249–263). B. Saunders.
Brudno, J. N., & Kochenderfer, J. N. (2019). Recent advances in CAR T-cell toxicity: Mechanisms, manifestations and management. In Blood Reviews (Vol. 34, pp. 45–55). Churchill Livingstone.
Ma, S., Li, X., Wang, X., Cheng, L., Li, Z., Zhang, C., Ye, Z., & Qian, Q. (2019). Current progress in car-t cell therapy for solid tumors. In International Journal of Biological Sciences (Vol. 15, Issue 12, pp. 2548–2560). Ivyspring International Publisher.
Han, D., Xu, Z., Zhuang, Y., Ye, Z., & Qian, Q. (2021). Current progress in CAR-T cell therapy for hematological malignancies. In Journal of Cancer (Vol. 12, Issue 2, pp. 326–334). Ivyspring International Publisher. https://doi.org/10.7150/JCA.48976
Martinez, M., & Moon, E. K. (2019). CAR T cells for solid tumors: New strategies for finding, infiltrating, and surviving in the tumor microenvironment. Frontiers in Immunology, 10(FEB).
Depil, S., Duchateau, P., Grupp, S. A., Mufti, G., & Poirot, L. (2020). ‘Off-the-shelf’ allogeneic CAR T cells: development and challenges. In Nature Reviews Drug Discovery (Vol. 19, Issue 3, pp. 185–199). Nature Research.
Sterner, R. C., & Sterner, R. M. (2021). CAR-T cell therapy: current limitations and potential strategies. In Blood Cancer Journal (Vol. 11, Issue 4). Springer Nature.
Zhang, C., Liu, J., Zhong, J. F., & Zhang, X. (2017). Engineering CAR-T cells. In Biomarker Research (Vol. 5, Issue 1). BioMed Central Ltd.