A 13 meses del inicio de la pandemia, la ciencia sigue teniendo un gran reto para poder manejar este problema de salud tan grande que se ha presentado con la enfermedad de Covid-19.
Los coronavirus pertenecen a la familia coronaviridae, los cuales se pueden clasificar en 4 géneros:1
- Alphacoronavirus: infectan mamíferos
- Betacoronavirus: infectan mamíferos
- Gammacoronavirus: infectan aves
- Deltacoronavirus: infectan aves y mamíferos
Los más representativos de cada familia se pueden observar en el siguiente esquema.1 (Fig 1)
El SARS-CoV-2 pertenece a la familia de los β-coronavirus, los cuales son virus de ácido ribonucleico (ARN) de cadena simple, polaridad positiva, envueltos, no segmentados, con genoma de 27 a 32 kb y tamaño de 80-160 nm.2
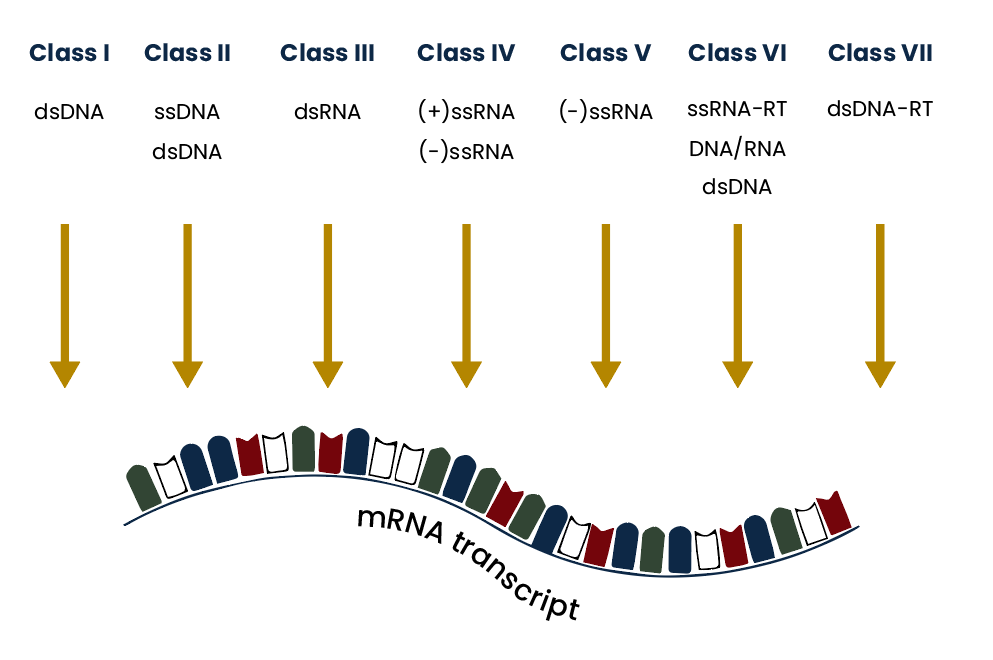
Hasta estos momentos, son los virus de ARN más grandes descubiertos y pertenecen al grupo IV de la clasificación de Baltimore. (Fig 2)
Fig 2. Clasificación de Baltimore.3
El sistema de clasificación de Baltimore, creado por el biólogo estadunidense David Baltimore, agrupa los virus según el tipo de genoma y estrategia de replicación.
En la gran batalla contra este problema de salud, la ciencia ha tenido que afrontar un gran desafío para poder encontrar tratamientos adecuados que ayuden a disminuir la carga viral del SARS-COV 2, ya que no es tan sencillo realizar nuevos medicamentos, se han ido tomando de medicamentos ya existentes y modificando las fórmulas para crear nuevos medicamentos y así realizar estudios preclínicos y clínicos en donde se pueda ver la disminución de la carga viral y los días de infección.
En mayo de 2020, el Ministerio de Salud de Rusia otorgó la autorización preliminar de comercialización del inhibidor de la RNA polimerasa AVIFAVIR* (FAVIPIRAVIR), para el tratamiento de pacientes con COVID-19.
AVFAVIR* (Favipiravir) es un inhibidor de RNA polimerasa, dependiente de RNA, su antecedente (Favipiravir) fue comercializado en Japón como (Avigan) y en China como (Favilavir), es el segundo tratamiento de línea en brotes de influenza nuevos o reemergentes.4
A principios del 2020, se informó que tenía actividad antiviral contra el SARS-CoV-2, en células Vero E6 (EC50, 61.88μM CC50 >400 μM, SI> 6.46), y para proporcionar un aclaramiento viral más corto en pacientes con COVID-19.4
Un ensayo clínico multicéntrico aleatorizado, en fase II/III, de AVIFAVIR* vs. el estándar de atención (SOC) en pacientes hospitalizados con neumonía moderada por COVID-19.4
El diseño del estudio se basó en las recomendaciones del Plan de la OMS R&D Blueprint.4
Durante el estudio, en todos los grupos, los pacientes pudieron hacer uso de tratamiento para sintomatología, pero en el grupo de Avifavir no se pudo utilizar otro antiviral, el criterio principal para la valoración de la eficacia fue la eliminación del SARS-CoV-2 en el día, realizando 2 pruebas de PCR con resultados negativos con un intervalo al menos de 24 hrs.4
Las evaluaciones que se incluyeron para evaluar a los pacientes fueron:
- Signos vitales diarios
- SpO2
- Escala ordinal de mejora clínica OMS (WHO-OSCI)
- PCR para la detección de SARS-CoV-2 (nasofaríngeo y orofaríngeo) en los días 5,10,15.
- Tomografía simple de tórax en el día 1 y día 15
- Exploración física
- Exámenes de laboratorio: biometría hemática y química sanguínea, PCR, EGO, EKG, en los días 1, 5 y 15.
Todos los pacientes asistieron a visitas de seguimiento en los días 22 y 29.
Al tener el consentimiento informado y los criterios de elegibilidad confirmado, 60 pacientes hospitalizados con neumonía por Covid-19 se asignaros 3 grupos de tratamiento:4
Los pacientes fueron aleatorizados en una proporción 1: 1: 1 para recibir AVIFAVIR* 1600 mg BID el día 1, seguido de 600 mg BID los días 2-14 (1600/600 mg); AVIFAVIR* 1800 mg BID el día 1, seguido de 800 mg BID los días 2-12 (1800/800 mg), o SOC de acuerdo con las guías rusas para el tratamiento de COVID-19.4
En los grupos que se administró Avifavir durante un periodo de 10,9 ± 2,8 días, en el grupo SOC se administró hidroxicloroquina a 15/20 (75,0%) pacientes.
La terapia concomitante en todos los grupos incluyó antibióticos, anticoagulantes y/o inmunosupresores, así como tratamientos extras para otros síntomas.
El aclaramiento viral en el día 5 se logró en 25/40 (62.5%) en el grupo de Avifavir, y en 6/20 (30%) en el grupo de SOC (P=0,018).4
En el día 10 el aclaramiento viral en el grupo de Avifavir 37/40 (92.5%), y en el grupo de SOC 16/20 (80%) (p=0,155).4 (Ver fig 1)
La regulación de la temperatura corporal (<37ºC) se logró en 2 días en el grupo de Avifavir y en 4 días en el grupo de SOC (p=0,007).4 (Ver fig 2)
En el día 15 las TC de tórax mejoraron en 36/40 (90%) pacientes con Avifavir y 16/20 (80%) pacientes con SOC (p=0,283).4
Las reacciones adversas a Avifavir en 7/40 (17.5%) pacientes, incluyeron diarrea, náusea, vómito, dolor torácico y aumento de las transaminasas hepáticas, las reacciones fueron leves a moderadas y solo en 2/40 (5%) de los pacientes se tuvo que interrumpir el tratamiento.4
Fig 1. Eliminación de SARS-CoV-2
Fig 2. Regulación de temperatura corporal
 Avifavir demostró una respuesta rápida antiviral contra SARS-CoV-2.
Avifavir demostró una respuesta rápida antiviral contra SARS-CoV-2.
En el día 5 alcanzaron una PCR negativa con ambos régimenes de dosificación, fue 2 veces mayor que en el grupo control (p<0,05).
No se observaron problemas de seguridad relacionados con Avifavir ya que todas las reacciones adversas fueron de leve a moderada y fueron notificadas previamente para Avigan.
No se observó un aumento de la toxicidad en pacientes que recibieron dosis más altas de Avifavir.
Se decidió tener la dosificación basado en el peso de la etapa inicial del estudio, con las dosis de carga de >44 mg/kg y duración del tratamiento hasta 10 días.
Referencias:
Li F. Structure, Function, and Evolution of Coronavirus Spike Proteins. Annual review of virology, 3(1), 237–261, (2016).
Aguilar GNE, Hernández SAA, Ibanes GC. Características del SARS-CoV-2 y sus mecanismos de transmisión. Rev Latin Infect Pediatr. 2020;33(3):143-148.
Greene SE, Reid A. Viruses Throughout Life & Time: Friends, Foes, Change Agents: A Report on an American Academy of Microbiology Colloquium San Francisco // July 2013. Washington (DC): American Society for Microbiology; 2013
Ivashchenko AA, Dmitriev KA, Vostokova NV, Azarova VN, Blinow AA, Egorova AN, Gordeev IG, Ilin AP, Karapetian RN, Kravchenko DV, Lomakin NV, Merkulova EA, Papazova NA, Pavlikova EP, Savchuk NP, Simakina EN, Sitdekov TA, Smolyarchuk EA, Tikhomolova EG, Yakubova EV, Ivachtchenko AV. AVIFAVIR for Treatment of Patients with Moderate COVID-19: Interim Results of a Phase II/III Multicenter Randomized Clinical Trial. Clin Infect Dis. 2020 Aug 9: ciaa1176. doi: 10.1093/cid/ciaa1176.