Los factores neurotróficos son familias de polipéptidos clasificados según su similitud aminoacídica y su función.
La característica general de estos factores es que cada familia participa en los procesos de migración, crecimiento, diferenciación y sobrevivencia de distintos tipos celulares. Los factores tróficos que regulan dichos procesos en las células nerviosas se denominan factores neurotróficos.1
El primer grupo de factores neurotróficos descubierto fue la familia de las neurotrofinas; sin embargo, se han descrito otros factores de crecimiento que son capaces de regular la sobrevivencia neuronal y que, por lo tanto, también se han considerados factores neurotróficos. Entre estos factores se encuentran el factor de crecimiento epidérmico (EGF), el factor de crecimiento de fibroblastos (FGF) y la familia de los factores de crecimiento similar a la insulina (IGF).1
La familia de neurotrofinas incluye el factor de crecimiento neuronal (NGF), el factor neurotrófico derivado del cerebro (BDNF) (Barde et al, 1982), la neurotrofina 3 (NT-3) (Ernfors et al, 1990), la neurotrofina 4/5 (NT-4/5) (Hallböök et al, 1991).1
Las neurotrofinas actúan sobre dos tipos de receptores, los denominados receptores de alta afinidad de tirosina cinasa (TrkA, TrkB y TrkC) y su receptor de baja afinidad (p75).
El descubrimiento del factor de crecimiento nervioso (NGF) por Rita Levi-Montalcini en la década de 1950 representa un hito importante en los procesos que condujeron a la biología celular moderna. El NGF fue el primer factor de crecimiento identificado, por su acción en la diferenciación morfológica de las células nerviosas derivadas de la cresta neural.2
La semilla para el descubrimiento de NGF fue expuesta por el trabajo de Viktor Hamburger en el que se demostró que, la extirpación quirúrgica de las alas de los embriones de pollo, redujo el número final de neuronas motoras en la columna motora lateral de la médula espinal y sensorial, las neuronas en los ganglios de la raíz dorsal a niveles segmentarios responsables de la inervación del tejido diana faltante, mientras que el trasplante de yemas de las extremidades supernumerarias tuvo el efecto opuesto de permitir el desarrollo de más neuronas motoras y neuronas sensoriales (Hamburger 1934, 1939). Así nació la llamada hipótesis neurotrófica, que afirma que “Cada parte del campo periférico controla directamente [el desarrollo de] su propio centro nervioso” junto con la idea de que alguna señal o sustancia debe moverse desde el axón terminal al cuerpo celular neuronal. para transmitir esta señal.3
El descubrimiento de NGF es ampliamente considerado por los neurobiólogos como el primer ejemplo claro de la identificación de una clase de moléculas tróficas que, aunque son químicamente distintas, pueden servir para el mismo propósito general de proporcionar un vínculo regulador entre los objetivos y las células nerviosas que los inervan. El NGF y otros factores similares también son objeto de intensas investigaciones actuales.2
Receptores
Las cuatro neurotrofinas interactúan con cuatro receptores; p75NTR, TrkA, TrkB y TrkC. La función de estos múltiples receptores es compleja, ya que los receptores p75NTR y Trk pueden funcionar de forma independiente, pero en las neuronas que expresan tanto los receptores p75NTR como los Trk, los receptores interactúan física y funcionalmente de manera que pueden alterar las propiedades de señalización de cada uno. La estructura y las funciones de señalización de estos receptores se analizan en detalle en otra parte de este libro. Brevemente, las cuatro neurotrofinas, tanto como proneurotrofinas como neurotrofinas maduras completamente procesadas, pueden unirse y activar la señalización por p75NTR, mientras que los receptores Trk prefieren unirse a neurotrofinas maduras y son selectivos para neurotrofinas particulares. NGF se une y activa preferentemente TrkA, NT3 se une y activa preferentemente TrkC, y BDNF y NT4 se unen y activan preferentemente TrkB. Por esta razón, BDNF y NT4 suelen ser funcionalmente redundantes en mamíferos y, reflejando esta redundancia, el gen NT4 aparentemente se ha perdido durante la evolución de las aves. NT3 es la más promiscua de las neurotrofinas, ya que el corte y empalme alternativo de la transcripción de TrkA puede generar formas de TrkA que son activadas eficazmente por NT3 (Clary y Reichardt 1994). Sin embargo, es importante destacar que NGF y NT3 no son funcionalmente equivalentes con respecto a la activación de TrkA, ya que influyen en la señalización de TrkA de manera diferente (Harrington et al. 2011).
Uno o más de los cuatro receptores de neurotrofina se expresan en una amplia variedad de tipos de neuronas y glía en el sistema nervioso central y periférico y también en una variedad de tipos de células no neurales. Por tanto, las neurotrofinas tienen una gama extraordinaria de funciones biológicas, estando determinada la preferencia de neurotrofina de diversas poblaciones de células por el receptor o receptores de neurotrofina particulares que expresan.3
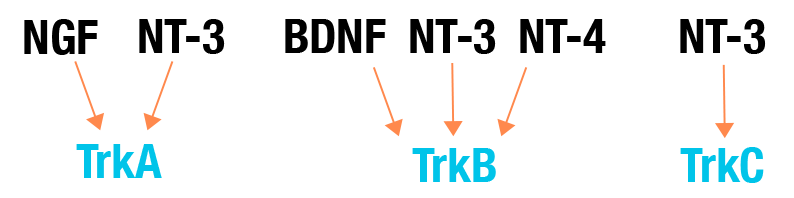
Especificidad de varios receptores Trk para miembros de la familia de las neurotrofinas. NGF, factor de crecimiento nervioso; NT, neurotrofina; BDNF, factor neurotrófico derivado del cerebro.
Secreción de neurotrofinas
Como la mayoría de los otros polipéptidos secretados biológicamente activos, la síntesis proteica de neurotrofinas se produce en el retículo endoplásmico rugoso, donde las proneurotrofinas se empaquetan en vesículas secretoras. Las proneurotrofinas, que varían de aproximadamente 210 a 270 residuos de aminoácidos de longitud, son procesadas dentro de estas vesículas por proteasas de la familia de proproteína convertasa (Seidah et al. 1996), produciendo las neurotrofinas maduras que tienen aproximadamente 120 residuos de longitud. En el caso del BDNF, el prodominio escindido se almacena y cosecreta con BDNF maduro (Dieni et al. 2012).3
Existe amplia evidencia de que algunos factores de crecimiento promueven una respuesta antioxidante ante un estado de estrés oxidativo (Wu et al, 2004, Dorrel et al,2009).1 Fig 1
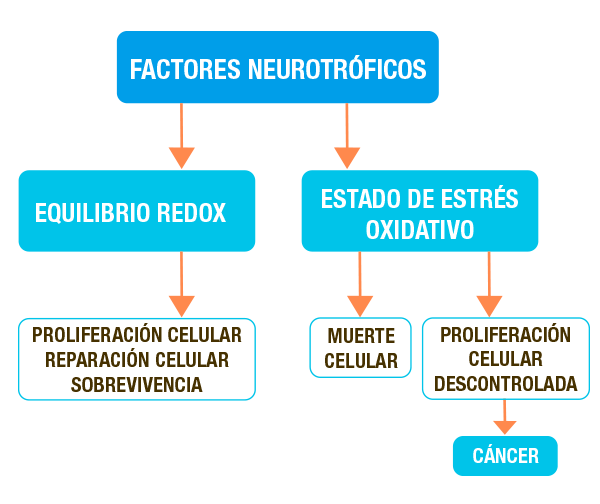
Esquema que muestra los posibles efectos de los factores neurotróficos en un equilibrio de óxido-reducción (redox) o en estado de estrés oxidativo en las células nerviosas.
El conocimiento de la señalización del factor neurotrófico ha mejorado dramáticamente nuestra comprensión de las formas en que el sistema nervioso evoluciona durante el desarrollo y se adapta a lo largo de la vida adulta de un organismo. Dicho conocimiento también ha proporcionado información sobre los mecanismos responsables de la supervivencia neuronal, cuyo fracaso puede ser la base de trastornos neurodegenerativos como la enfermedad de Alzheimer, la enfermedad de Parkinson, la enfermedad de Huntington y la esclerosis lateral amiotrófica (ELA).4
Los factores neurotróficos en sí mismos son factores de crecimiento de péptidos para las células nerviosas: influyen en el ciclo celular, el crecimiento, la diferenciación y la supervivencia de las neuronas. Debido a la superposición entre los factores de crecimiento de las neuronas y la glía, también aplicamos el término factor neurotrófico a cualquier molécula que produzca efectos tróficos en el sistema nervioso al influir en la glía. Para aumentar la confusión, el término neurotrofina se aplica solo a una familia de factores neurotróficos. Como los neurotransmisores, muchos factores neurotróficos son sintetizados por neuronas y alteran el funcionamiento de otras neuronas; en algunas circunstancias, incluso pueden liberarse como resultado de la actividad neuronal. Además, algunos factores neurotróficos, como el factor neurotrófico derivado del cerebro (BDNF), pueden producir cambios rápidos en las neuronas diana que son indistinguibles de los provocados por los neurotransmisores convencionales.4

El efecto del factor de crecimiento nervioso (NGF) en neuronas espinales cultivadas. (Adaptado con permiso de Levi-Montalcini R. El factor de crecimiento nervioso 35 años después. Science. 1987; 237: 1157.)
Por ejemplo, NGF promueve la supervivencia de neuronas colinérgicas en los núcleos septales del prosencéfalo basal, y BDNF, NT-3 y NT-4 promueven la supervivencia de algunas neuronas motoras corticales e hipocampales, y de neuronas noradrenérgicas, dopaminérgicas y serotoninérgicas, ubicado en el tronco encefálico. Dado que las neuronas colinérgicas se ven afectadas en las primeras etapas de la enfermedad de Alzheimer, se ha propuesto el NGF como un tratamiento potencial; se ha propuesto el uso de otras neurotrofinas para el tratamiento de la enfermedad de Parkinson.
La evidencia sugiere que las neurotrofinas pueden modular la transmisión sináptica y regular la formación y el fortalecimiento de las sinapsis. Tales acciones pueden estar mediadas por la interferencia entre las vías de señalización de neurotrofinas y neurotransmisores.4
Más que salud
Grupo Health Care
Referencias:
Castillo, Diana & Rivas-Arancibia, Selva. (2011). Interacción entre factores neurotróficos y especies reactivas de oxígeno en los mecanismos de muerte y proliferación celular. ARCHIVOS DE NEUROCIENCIA. 16. 26-32.
Aloe, L. (2004). Rita Levi-Montalcini: the discovery of nerve growth factor and modern neurobiology. Trends in Cell Biology, 14(7), 395–399.
Bothwell, M. (2014). NGF, BDNF, NT3, and NT4. Handbook of Experimental Pharmacology, 3–15.
Nestler E J, et al.,
Molecular Neuropharmacology: A Foundation for Clinical Neuroscience, McGraw-Hill Professional, 2008








