En estos años se han mostrado diferentes medicamentos para la protección del tejido neuronal durante un EVC, así que seleccionamos la mejor opción cómo nuestra tercera inclusión en las guías de tratamiento, hemos sugerido el uso de Cerebrolysin desde el inicio del padecimiento.
Nota: El uso de Cerebrolysin no requiere un diagnóstico diferencial entre un EVC isquémico y uno hemorrágico, tampoco presenta ninguna contraindicación con la terapia trombolítica, inclusive los estudios señalan mejores resultados cuando se usan en conjunto Cerebrolysin y Alteplasa.7
¿Qué es Cerebrolysin?
Cerebrolysin es una preparación péptida obtenida a partir de proteínas purificadas por descomposición enzimática controlada estandarizada de cerebro porcino, se compone de oligopéptidos de bajo peso molecular en un 80% y en un 20% de aminoácidos (lisina, arginina, treonina, valina, leucina, etc.) con efectos neuro protectores y neurotróficos.1 Se ha visto en los diferentes estudios clínicos que los pacientes han sufrido menor daño neuronal durante un EVC y han tenido una mejor respuesta a la rehabilitación utilizando este fármaco.
Los neuropéptidos se sintetizan de otro modo y tienen acciones que normalmente son lentas y bastante diferentes en otros aspectos, de las que ejercen los transmisores de molécula pequeña. Estas sustancias no se sintetizan en el citoplasma de los terminales presinápticos. Por el contrario, se forman en los ribosomas del soma neuronal ya como porciones íntegras de grandes moléculas proteicas. Las moléculas proteicas penetran a continuación en los espacios existentes en el retículo endoplásmico del soma y posteriormente en el aparato de Golgi, donde suceden dos cambios:2
- En primer lugar, la proteína formadora de neuropéptidos sufre una escisión enzimática en fragmentos más pequeños, algunos de los cuales son el propio neuropéptido o un precursor suyo.2
- En segundo lugar, el aparato de Golgi introduce el neuropéptido en minúsculas vesículas transmisoras que se liberan hacia el citoplasma. A continuación, se transportan por el axón en todas las direcciones hacia el extremo de las fibras nerviosas a través de la corriente axónica del citoplasma, viajando a una velocidad de tan solo unos pocos centímetros al día. Finalmente, estas vesículas vierten su contenido en los terminales neuronales como respuesta a los potenciales de acción de la misma manera que los transmisores de molécula pequeña. Sin embargo, la vesícula sufre una autolisis y no se reutiliza.2
Debido a este laborioso método de formación de los neuropéptidos, normalmente se libera una cantidad mucho menor que de los transmisores de molécula pequeña. Esto se compensa en parte por el hecho de que en general poseen una potencia mil veces mayor o más, que los transmisores de molécula pequeña. Otra característica importante de los neuropéptidos es que a menudo ocasionan acciones mucho más duraderas. Algunas de ellas consisten en el cierre prolongado de los canales de calcio, los cambios persistentes en la maquinaria metabólica de las células, en la activación o la desactivación de genes específicos dentro del núcleo celular, o en alteraciones a largo plazo de la cantidad de receptores excitadores o inhibidores. Algunos de estos efectos duran días, pero otros quizá meses o años.2
En diferentes estudios clínicos y en metaanálisis, se han visto resultados favorables para el uso de este tratamiento (CASTA Heiss et al. 2012, CERE-LYSE-I Lang et al. 2013, CARS-1 Muresanu et al. 2016, CARS-2 Guekht 2015, MRI-1, MRI-2, Neurol Sci (2018) 39:629–640 Bornstein NM).
Los factores de crecimiento son mediadores biológicos esenciales que ocurren naturalmente y promueven el crecimiento celular, la diferenciación, la supervivencia y la función en poblaciones específicas de células nerviosas. El descubrimiento del factor de crecimiento nervioso (NGF) por Rita Levi-Montalcini en la década de 1950 representa un hito importante en los procesos que condujeron a la biología celular moderna. El NGF fue el primer factor de crecimiento identificado, por su acción en la diferenciación morfológica de las células nerviosas derivadas de la cresta neural.3
Los factores tróficos, son familias de polipéptidos clasificados según su similitud aminoacídica y su función. La característica general de estos factores es que cada familia participa en los procesos de migración, crecimiento, diferenciación y sobrevivencia de distintos tipos celulares. Los factores tróficos que regulan dichos procesos en las células nerviosas se denominan factores neurotróficos.4
El primer grupo de factores neurotróficos descubierto fue la familia de las neurotrofinas. Estas incluyen el factor de crecimiento neuronal (NGF), el factor neurotrófico derivado del cerebro (BDNF) (Barde et al,1982), la neurotrofina 3 (NT-3) (Ernfors et al, 1990), la neurotrofina 4/5 (NT-4/5) (Hallböök et al, 1991).4
Las neurotrofinas median una gama extraordinaria de otras funciones, por ejemplo, pueden promover la supervivencia neuronal o la muerte celular neuronal, dependiendo de las siguientes circunstancias, el receptor empleado y si hay formas maduras o proneurotrofinas. En algunos casos, la asociación neurotrofina / receptor promueve la señalización supervivencia, en otros casos, la asociación neurotrofina / receptor promueve la señalización muerte (Rajagopal et al. 2004), y en otros casos, la asociación neurotrofina / receptor termina la actividad de un receptor que señala constitutivamente promuerte (Huang y McNamara 2010; Lee et al. 2002).5
Además, aunque la acción de la neurotrofina a veces se ajusta a la hipótesis neurotrófica original, que predice que las neurotrofinas deben transmitir señales tróficas desde el extremo del axón de forma retrógrada de regreso al soma neuronal, en algunos casos, y particularmente para el BDNF, las neurotrofinas pueden transportarse de manera anterógrada hacia los axones para transportar las señales a las células postsinápticas (Altar et al. 1997; Conner et al. 1997; Smith et al. 1997; von Bartheld et al. 1996; Zhou y Rush 1996).5
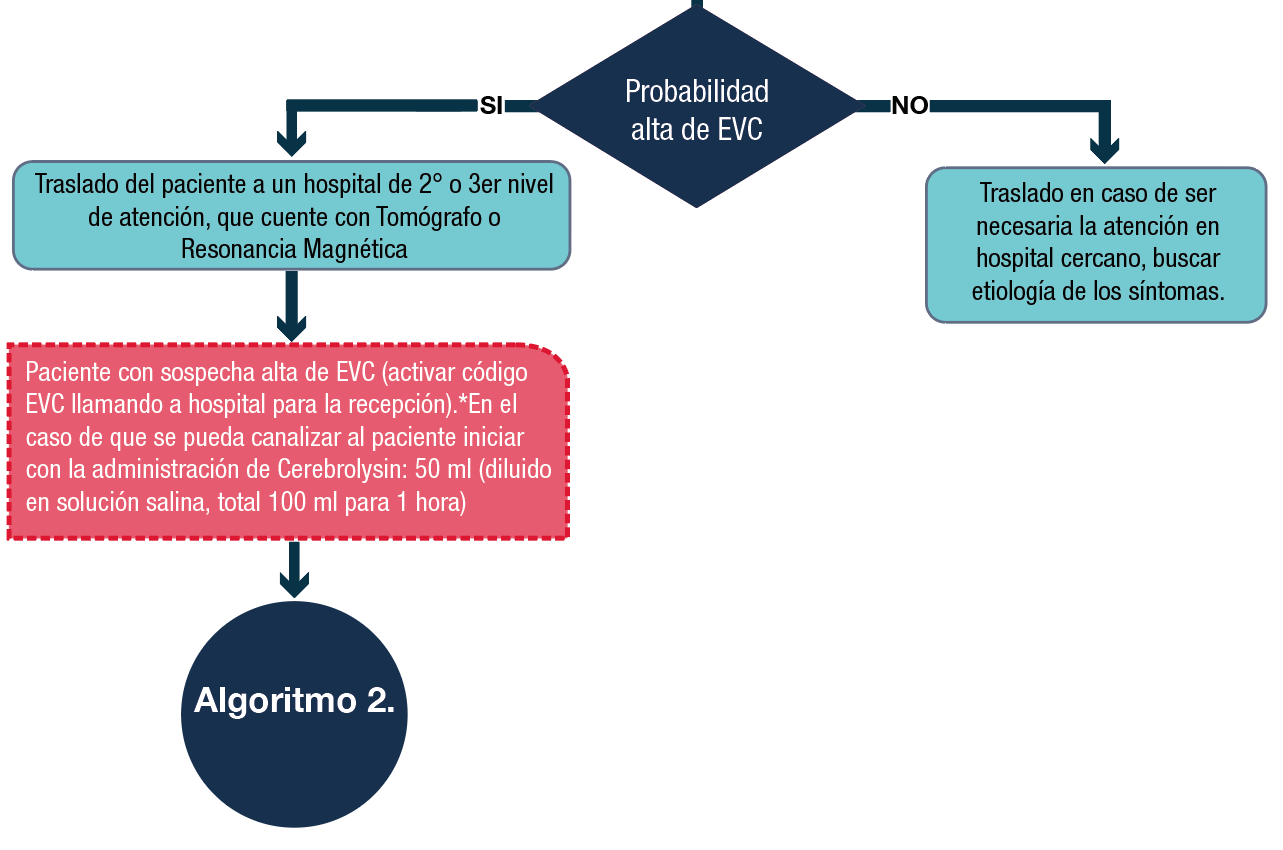
Por este motivo se sugiere iniciar con una dosis desde el inicio del evento, aunque en ocasiones se pueden presentar limitantes, por ejemplo, las unidades de ambulancia no tienen los suministros adecuados o la capacitación del personal médico no es el adecuado para canalizar. Únicamente si el personal cuenta con la adecuada capacitación y materiales necesarios, se recomienda iniciar con la dosis de 30-50 ml (diluido en solución salina, total 100 ml para 1 hora), este escenario sería lo ideal, el iniciar con alguna de estas dosis, en caso de que el SEM lo pueda hacer, de otra forma, se deberá iniciar con el tratamiento farmacológico hasta llegar al hospital.
Dosificación
Ver dosificaciónLa principal ventaja que tenemos al utilizar Cerebrolysin, es que este fármaco no interfiere con los tratamientos de base y tampoco se han encontrado eventos adversos graves que interfieran en el resto del manejo de un EVC; se ha comprobado su eficacia y seguridad junto con el uso de alteplasa y otros medicamentos que se necesitan usar en el abordaje completo del evento.7
Los resultados de los pacientes que han sido tratados con este medicamento han sido favorables para reducir sus alteraciones neurológicas y la parte de rehabilitación sea mucho más favorable.
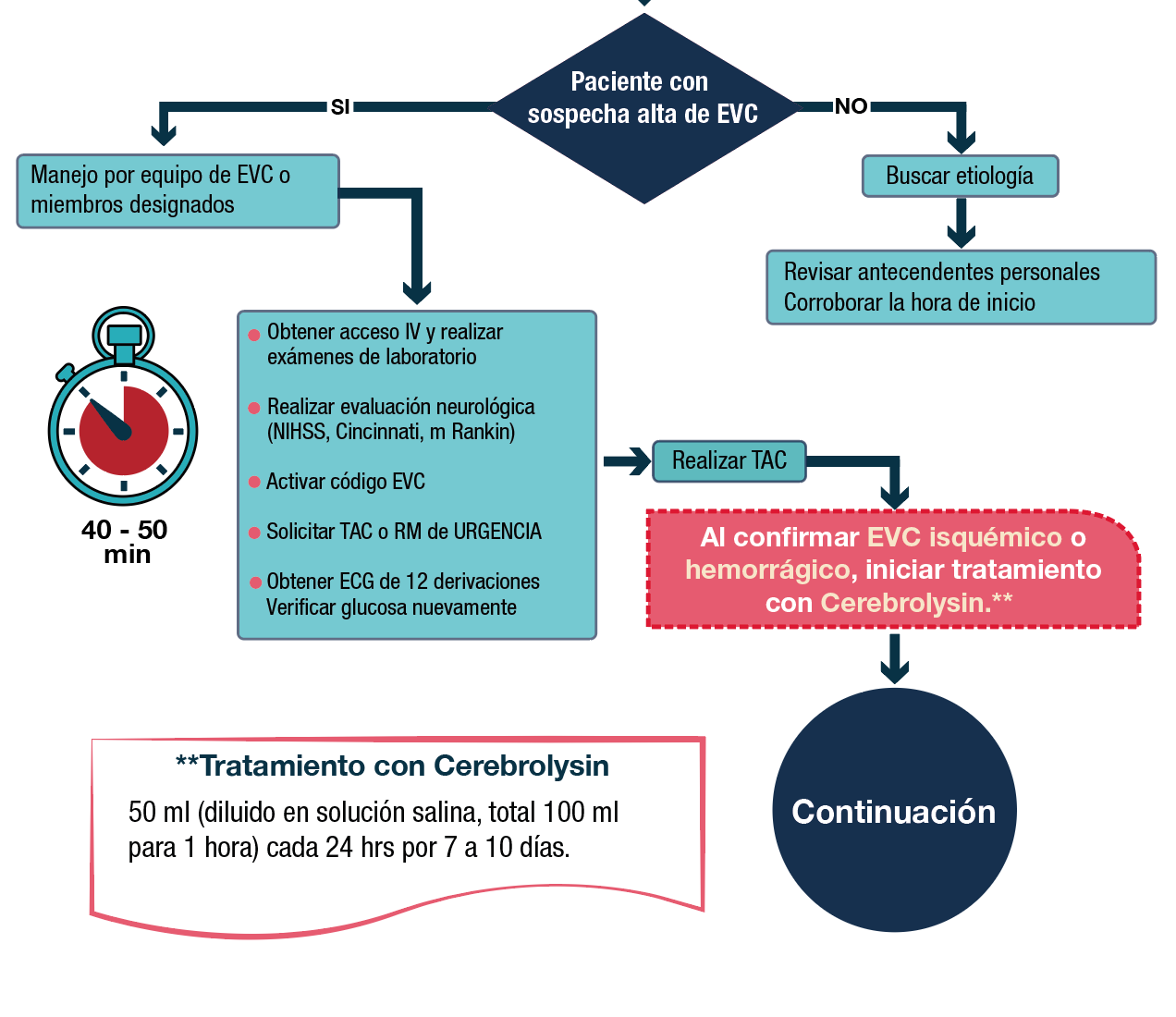
Hacemos la sugerencia del inicio de neuroprotección con Cerebrolysin, 50 ml (diluido en solución salina, total 100 ml para 1 hora) cada 24 hrs por 5 días, porque se ha visto en los estudios clínicos que ya comentamos anteriormente, resultados favorables al iniciar el tratamiento a las 24 o 72 hrs posteriores al evento, la dosis de 50 ml se ha manejado en los estudios y no han tenido EA´s graves o interacciones con el resto de los medicamentos aplicados a los pacientes como se observó en el metaanálisis (Bornstein N M, et al. Neurological Sciences (2018) 39:629–640) todos los estudios son prospectivos, aleatorizados, doble ciego, controlados con placebo, los pacientes fueron tratados con 30-50 ml de Cerebrolysin una vez al día, en un rango de 10 a 21 días, el inicio del tratamiento fue después de las 72 h posteriores al EVC.6
Se sugiere el inicio del tratamiento en cuanto la sospecha del EVC sea alta. Los resultados han sido favorables cuando se inicia el tratamiento, 12, 24 o 72 hrs después del diagnóstico. El daño que puede tener el paciente es mucho menor y la recuperación será más rápida.
- En cinco estudios, los datos de análisis originales estaban disponibles para el metaanálisis (análisis de datos de pacientes individuales); para cuatro estudios, se utilizaron datos agregados.6
El número combinado necesario para tratar los cambios clínicamente relevantes en los primeros NIHSS fue de 7.7 (IC del 95%: 5.2 a 15.0). El análisis ordinal a escala completa adicional de la escala de Rankin modificada en el día 90, en pacientes de moderados a severos dio lugar a MW 0.61 con significación estadística en favor de Cerebrolysin (IC 95% 0.52 a 0.69, P = 0.0118, N = 314). Los aspectos de seguridad fueron comparables al placebo. Nuestro metaanálisis confirma evidencia previa de que Cerebrolysin tiene un efecto beneficioso sobre los déficits neurológicos globales tempranos en pacientes con EVC agudo.6
Referencias:
Skvortsova VI, Stakhoskaya LV, Gubsky LV, Shamalov IV, Randomized, DoubleBlind, Placebo-Controlled Study of CerebrolysinSafety and Efficacy in Treatment of Acute Ischemic Stroke. Stroke 2004; 11.
Hall J E, Guyton y Hall Tratado de Fisiología médica. 12ª ed., Elsevier, 2011, unidad IX, capítulo 45.
Aloe, L. (2004). Rita Levi-Montalcini: the discovery of nerve growth factor and modern neurobiology. Trends in Cell Biology, 14(7), 395–399.
Castillo, Diana & Rivas-Arancibia, Selva. (2011). Interacción entre factores neurotróficos y especies reactivas de oxígeno en los mecanismos de muerte y proliferación celular. ARCHIVOS DE NEUROCIENCIA. 16. 26-32.
Bothwell, M. (2014). NGF, BDNF, NT3, and NT4. Handbook of Experimental Pharmacology, 3–15.
Bornstein N M, et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurological Sciences, 39(4), 629–640, 2017.
Lang, W., Stadler, C. H., Poljakovic, Z., & Fleet, D. (2012). A Prospective, Randomized, Placebo-Controlled, Double-Blind Trial about Safety and Efficacy of Combined Treatment with Alteplase (rt-PA) and Cerebrolysin in Acute Ischaemic Hemispheric Stroke. International Journal of Stroke, 8(2).
Recomendaciones de las guías de tratamiento para un EVC
A pesar de que en las guías no existe la recomendación del uso de neuroprotección, existe suficiente evidencia internacional donde podemos ver cómo el uso de Cerebrolysin ha sido favorable para los pacientes que han sufrido un EVC y se ha visto una recuperación adecuada.
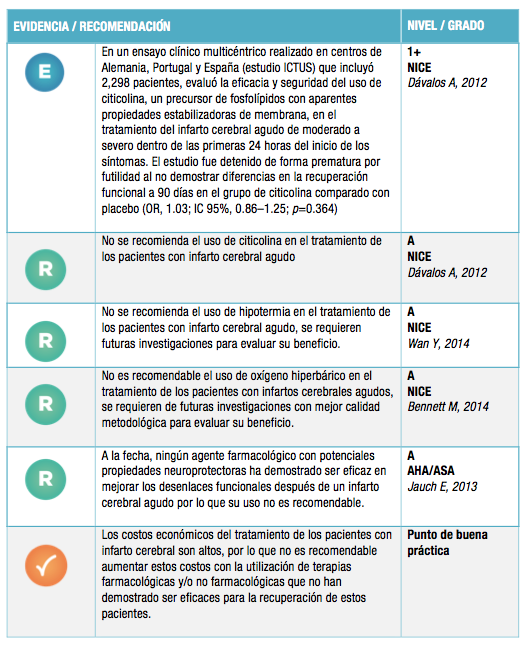
La evidencia internacional muestra una absoluta diferencia entre los pacientes que fueron atendidos con Cerebrolysin y los que no y cómo los pacientes que fueron tratados con un fármaco de soporte como Cerebrolysin obtuvieron un mejor pronóstico durante y posterior al EVC.
Soporte y evidencia clínica – Cerebrolysin
Inclusión en el Algoritmo
Como lo mencionamos anteriormente, nuestra recomendación es utilizar Cerebrolysin desde que existe una probabilidad alta de que el paciente este sufriendo un EVC. Propiciando una mayor probabilidad en la contención del daño neuronal.
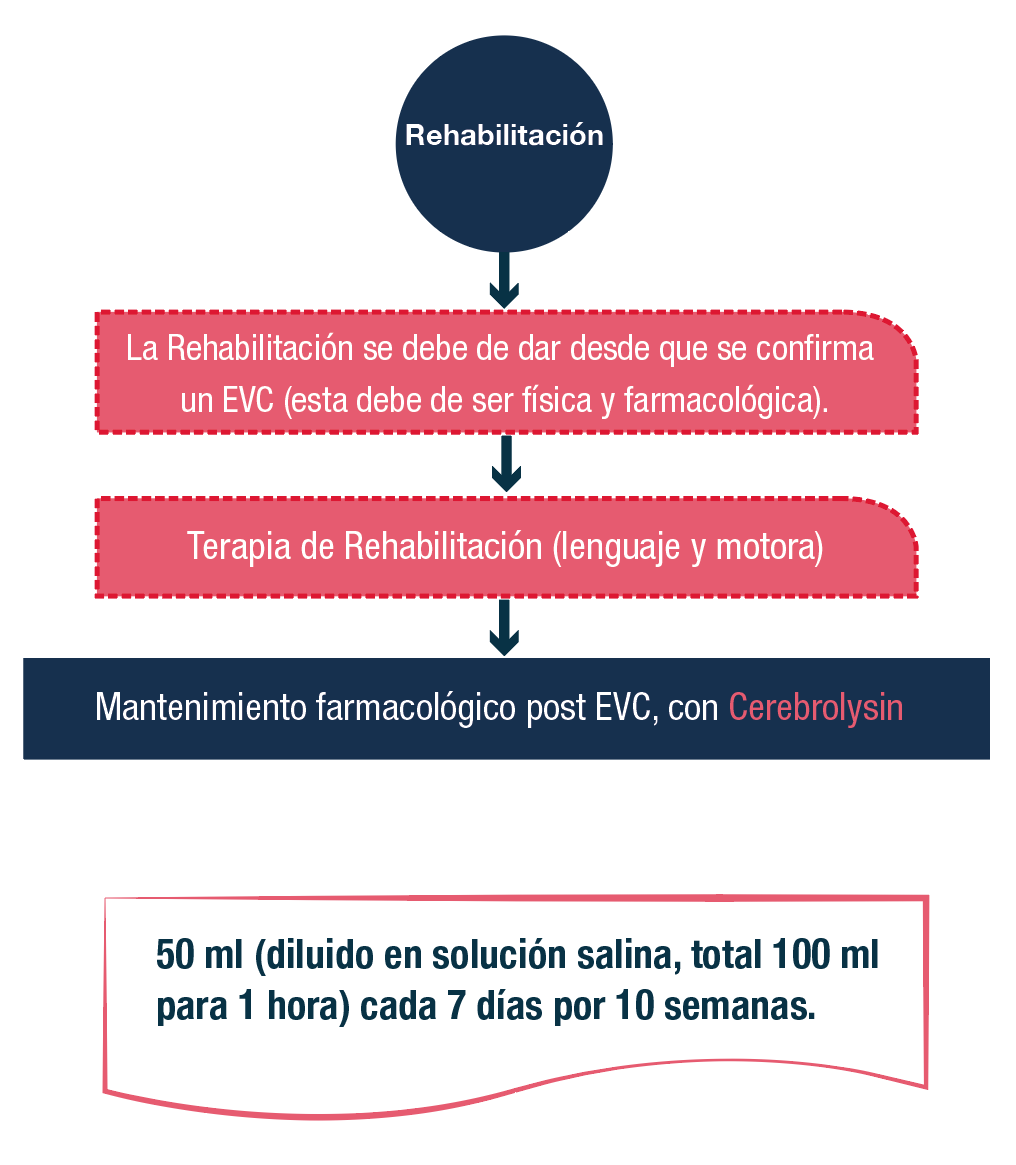
Como lo mencionamos en los estudios clínicos anteriores, la terapia de rehabilitación física y farmacológica es necesaria y los resultados son satisfactorios, por este motivo se sugiere que se mantenga la dosis de 50 ml 1 vez cada 7 días, por 10 semanas.
Nuestro objetivo es lograr un tratamiento integral que permita mayores posibilidades en la reducción de daño neuronal y las secuelas, propiciando una mayor probabilidad en la contención del daño y una mejor respuesta a la rehabilitación temprana.
ALGORITMOS
- Detección y traslados
- Atención y tratamiento
- Rehabilitación
- Índice Trombólisis
- Justificación del algoritmo
Contexto
En la actualidad los tratamientos farmacológicos han estado enfocados y bien establecidos para cada tipo de EVC, en el caso del isquémico, si el paciente llega en tiempo de ventana (3 hrs, algunos hasta 4.5 hrs) y si cumple con los criterios, se podrá administrar la terapia fibrinolítica, algunos con terapia endovascular podrán ser tratados. En el caso del hemorrágico, se debe determinar si es candidato a cirugía o sólo tratamiento de sostén por la unidad de cuidados intensivos (UCI), todo lo anterior tiene bien establecido los protocolos a seguir, para salvar la vida de los pacientes que presenten esta patología. Pero la realidad es que existen más factores que debemos cuestionar, sabemos que es de suma importancia establecer el tipo de EVC y el tratamiento correspondiente, pero ¿Dónde queda la protección del tejido cerebral?
Otra de las áreas de oportunidad sobre este padecimiento, es la neuroprotección, hemos visto a lo largo de los años que se han tratado de utilizar diferentes fármacos para proteger el tejido neuronal, pero lamentablemente en diferentes estudios clínicos no se habían visto resultados favorables o no se presentaban diferencias importantes en la recuperación de los pacientes.
El concepto de neuroprotección ha ido evolucionado, se necesita una protección para las unidades funcionales como las neuronas, células gliales, pericitos, macrófagos y la vasculatura. Al presentar una isquemia, en el tejido cerebral se producen una serie de mecanismos complejos que van dañando las células ya mencionadas, este presenta una respuesta a este daño con protección al resto del tejido neuronal. La etapa subaguda después de un EVC es el período crítico en el cual el tejido cerebral es más receptivo a la modificación por estímulos como terapia física y farmacológica.
Referencias
Guekht A, et al. Safety and efficacy of Cerebrolysin in motor function recovery after stroke: a meta-analysis of the CARS trials. Neurological Sciences, 38(10), 1761–1769,
Heiss, W.-D., Brainin, M., Bornstein, N. M., Tuomilehto, J., & Hong, Z. Cerebrolysin in Patients With Acute Ischemic Stroke in Asia: Results of a Double-Blind, Placebo-Controlled Randomized Trial. Stroke, 43(3), 630–636,
Chang, W. H., Park, C., Kim, D. Y., Shin, Y.-I., Ko, M.-H., Lee, A., … Kim, Y.-H. Cerebrolysin combined with rehabilitation promotes motor recovery in patients with severe motor impairment after stroke. BMC Neurology, 16(1)(2016).
Brainin, M., Cerebrolysin: a multi-target drug for recovery after stroke. Expert Review of Neurotherapeutics, 1–7. 2018
Muresanu D F, et al. Current Drug Treatment of Acute Ischemic Stroke: Challenges and Opportunities, CNS Drugs; 33(9):841–847, 2019.
Ladurner, G., Kalvach, P., & Moessler, H. (2004). Neuroprotective treatment with Cerebrolysin in patients with acute stroke: a randomised controlled trial. Journal of Neural Transmission, 112(3), 415–428.
Muresanu, D. F., Heiss, W.-D., Hoemberg, V., Bajenaru, O., Popescu, C. D., Vester, J. C., … Guekht, A. (2015). Cerebrolysin and Recovery After Stroke (CARS). Stroke, 47(1), 151–159